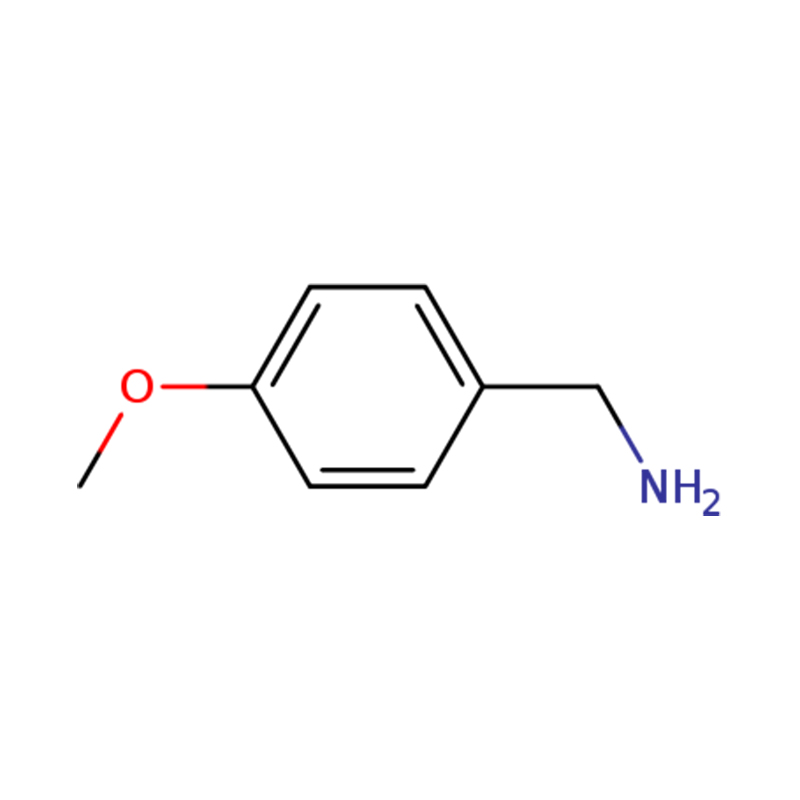
1-(4-METOXYFENYL)METÁNAMÍN
Detaily produktu
| Číslo casu | 2393-23-9 | Dodacia lehota | do 10 dní |
| Molekulárna | C8H11NO | Výrobná kapacita | 1 metrická tona/deň |
| Vzhľad | Číra, bezfarebná až mierne žltá tekutina | Čistota | 99 % min. |
| Aplikácia | Farmaceutické medziprodukty | Skladovanie | Izbová teplota, tma, uzavreté |
| LimitNum | 1 kilogram | Doprava | Letecká, námorná, expresná. |
| Hustota | 1,05 g/ml pri 25 °C (osvetlené) | Bod varu | 236 – 237 °C (osvetlené) |
| Bod topenia | -10°C | Index lomu | n20/D1.546 (doslova) |
| Bod vzplanutia: | >230°F | Rozpustnosť | Vysoko rozpustný vo vode |
| Meno | p-anisylamín alebo (4-metoxyfenyl)metanamín |
Synonymá
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETYL-ANIZOL; 4-METOXYBENZYLAMÍN; P-Metoxybenzylamín hydrochlorid 173,64; 4-Metoxybenzylamín, 98+ %; pre sparfloxacín; P-METOXYBENZYLAMÍN HYDROCHLORID
Aplikácia
Môže sa použiť na syntézu farmaceutických medziproduktov. Je mierne škodlivý pre vodu. Nedovoľte, aby sa neriedený produkt alebo veľké množstvá produktov dostali do kontaktu s podzemnou vodou, vodnými tokami alebo kanalizačnými systémami. Bez povolenia vlády nevypúšťajte materiály do okolitého prostredia, aby ste predišli kontaktu s oxidmi, kyselinami, vzduchom a oxidom uhličitým. Uchovávajte nádobu uzavretú, vložte ju do tesne uzavretej nádoby a skladujte na chladnom a suchom mieste.
Laboratórium kontroly kvality
V areáli sa nachádza samostatné laboratórium kontroly kvality, kde sa vykonávajú chemické, fyzikálne testy, mikrobiálne testy, štúdie stability a prístrojové testy, ako napríklad IR, UV, HPLC a GC, pre suroviny a hotové výrobky. Celý priestor má kontrolovaný prístup a je dobre udržiavaný s dostatočným množstvom analytických prístrojov na zamýšľaný účel testovania. Všetky prístroje sú dobre označené a vhodne kalibrované.
QA
Oddelenie kvality je zodpovedné za vyhodnotenie a kategorizáciu odchýlky na závažnú, všeobecnú a menej závažnú úroveň. Pre všetky úrovne odchýlok je potrebné vykonať vyšetrovanie na identifikáciu hlavnej alebo potenciálnej príčiny. Vyšetrovanie musí byť dokončené do 7 pracovných dní. Po ukončení vyšetrovania a identifikácii hlavnej príčiny je potrebné aj posúdenie vplyvu produktu spolu s plánom CAPA. Odchýlka sa uzavrie po implementácii CAPA. Všetky odchýlky na úrovni by mal schváliť manažér QA. Po implementácii sa účinnosť CAPA potvrdí na základe plánu.