Pozadie a dizajn štúdie
Retatrutid (LY3437943) je nový liek s jedným peptidom, ktorý aktivujetri receptory súčasne: GIP, GLP-1 a glukagón. Na vyhodnotenie jeho účinnosti a bezpečnosti u jedincov s obezitou, ale bez diabetu, bola vykonaná randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia fázy 2 (NCT04881760). Celkovo338 účastníkovs BMI ≥30 alebo ≥27 s aspoň jednou komorbiditou súvisiacou s hmotnosťou boli randomizovaní na užívanie placeba alebo retatrutidu (1 mg, 4 mg s dvoma titračnými schémami, 8 mg s dvoma titračnými schémami alebo 12 mg) podávaného raz týždenne subkutánnou injekciou počas 48 týždňov.primárny koncový bodbola percentuálna zmena telesnej hmotnosti v 24. týždni, pričom sekundárne koncové body zahŕňali zmenu hmotnosti v 48. týždni a prahy kategorického úbytku hmotnosti (≥5 %, ≥10 %, ≥15 %).
Kľúčové výsledky
-
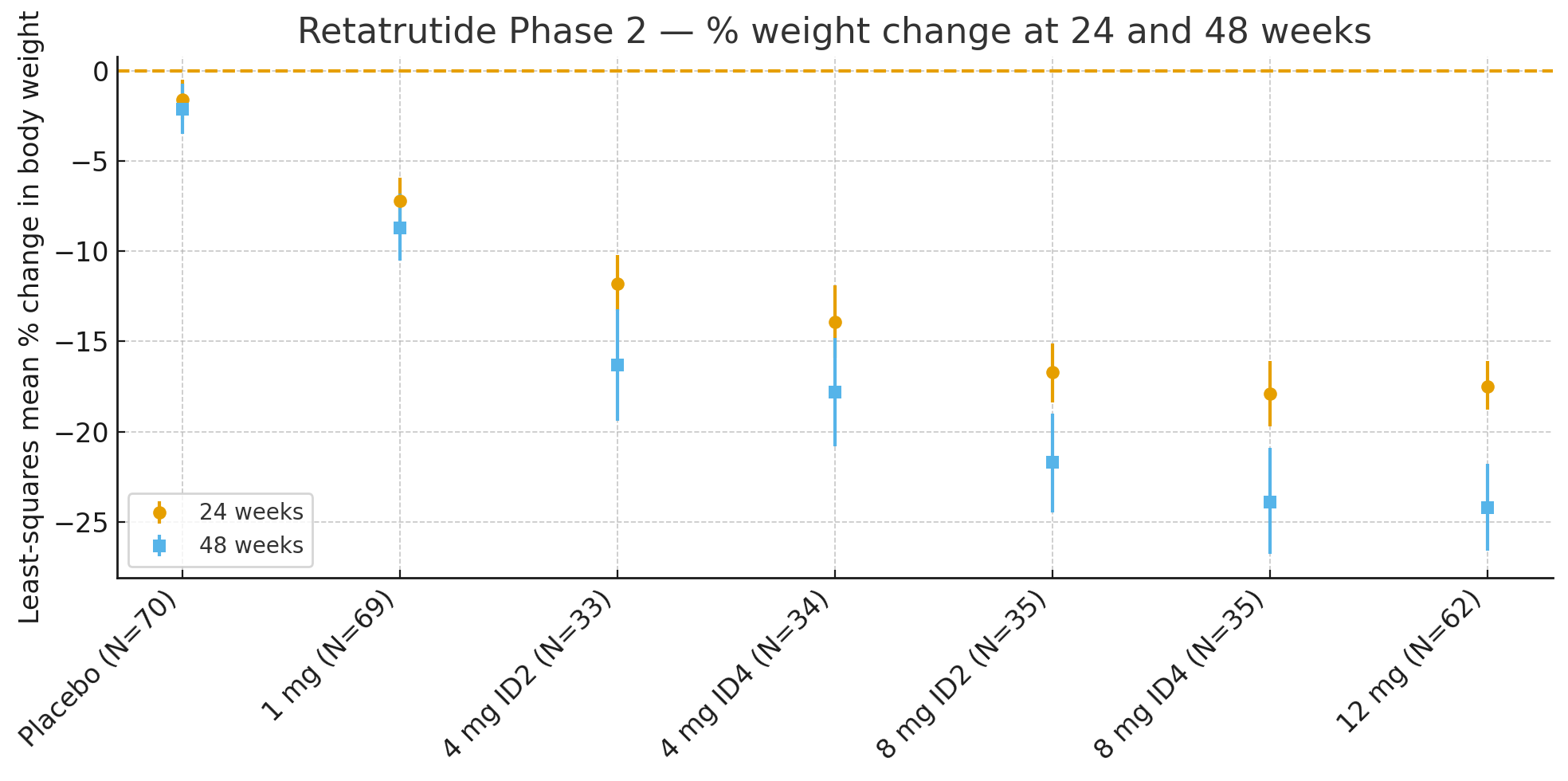
24 týždňovPriemerná percentuálna zmena telesnej hmotnosti v porovnaní s východiskovou hodnotou vypočítaná metódou najmenších štvorcov bola
-
Placebo: −1,6 %
-
1 mg: −7,2 %
-
4 mg (kombinované): −12,9 %
-
8 mg (kombinované): −17,3 %
-
12 mg: −17,5 %
-
-
48 týždňovPercentuálna zmena telesnej hmotnosti bola
-
Placebo: −2,1 %
-
1 mg: −8,7 %
-
4 mg (kombinované): −17,1 %
-
8 mg (kombinované): −22,8 %
-
12 mg: −24,2 %
-
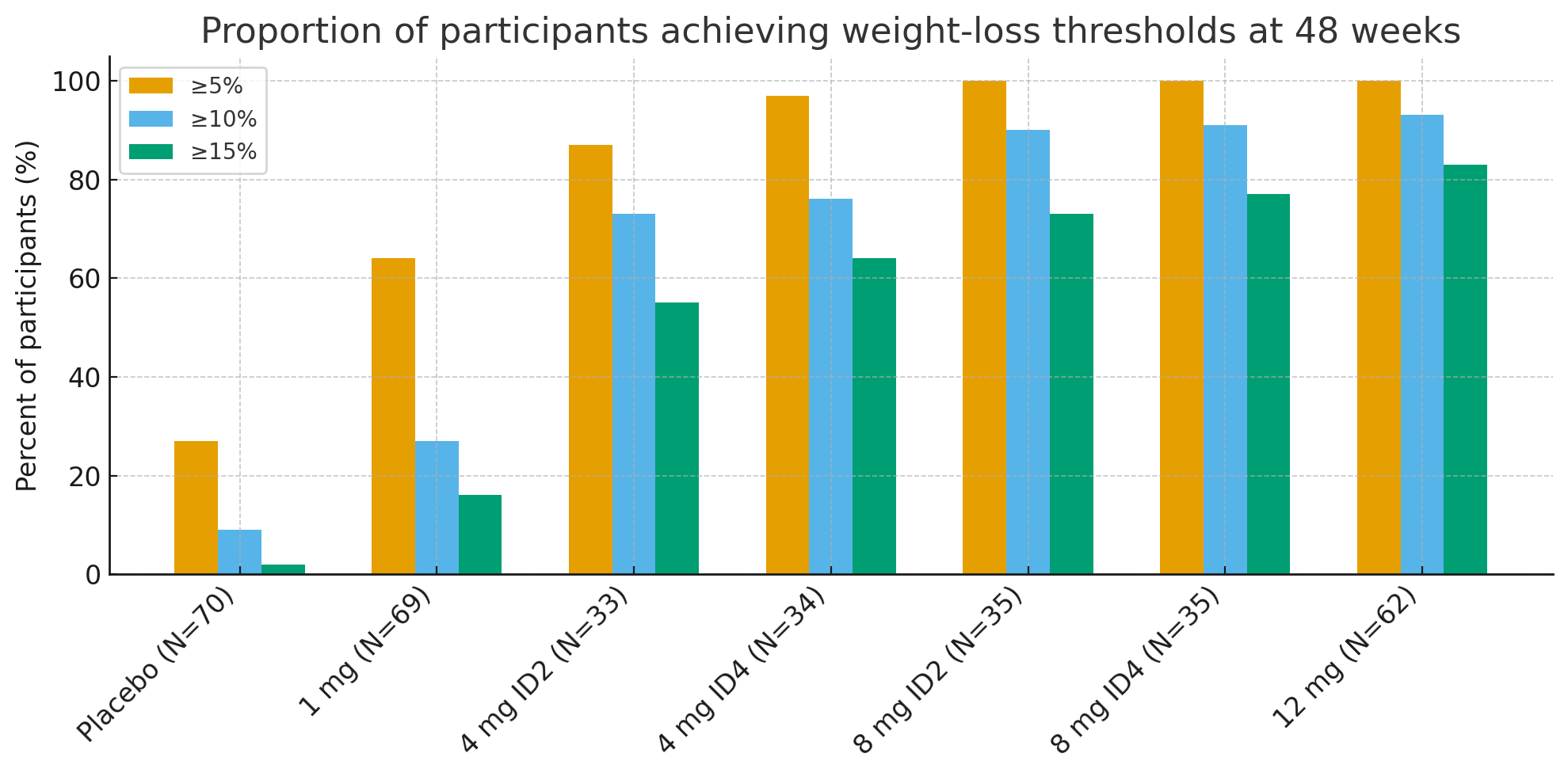
V 48. týždni boli podiely účastníkov, ktorí dosiahli klinicky významné prahy úbytku hmotnosti, pozoruhodné:
-
Úbytok hmotnosti ≥5 %: 27 % s placebom oproti 92 – 100 % v skupinách s aktívnou liečbou
-
≥10 %: 9 % s placebom oproti 73 – 93 % v skupinách s aktívnou liečbou
-
≥15 %: 2 % s placebom oproti 55 – 83 % v skupinách s aktívnou liečbou
V skupine s 12 mg až26 % účastníkov stratilo ≥30 % svojej východiskovej hmotnosti, čo je rozsah úbytku hmotnosti porovnateľný s bariatrickou chirurgiou.
Bezpečnosť
Najčastejšie nežiaduce účinky boli gastrointestinálne (nevoľnosť, vracanie, hnačka), vo všeobecnosti mierne až stredne závažné a závislé od dávky. Nižšie počiatočné dávky (titrácia 2 mg) znížili tieto účinky. Pozorovalo sa zvýšenie srdcovej frekvencie súvisiace s dávkou, ktoré dosiahlo vrchol v 24. týždni a potom klesalo. Miera ukončenia liečby sa v aktívnych skupinách pohybovala od 6 do 16 %, čo je o niečo viac ako pri placebe.
Závery
U dospelých s obezitou bez cukrovky viedol týždenný subkutánny retatrutid počas 48 týždňov kpodstatné, od dávky závislé zníženie telesnej hmotnosti(priemerná strata až do ~24 % pri najvyššej dávke) spolu so zlepšením kardiometabolických markerov. Gastrointestinálne nežiaduce udalosti boli časté, ale zvládnuteľné titráciou. Tieto zistenia fázy 2 naznačujú, že retatrutid by mohol predstavovať nový terapeutický štandard pre obezitu, pričom sa očakáva potvrdenie vo väčších, dlhodobých štúdiách fázy 3.
Čas uverejnenia: 28. septembra 2025